この記事の目次:
1. アミノ酸の開発
2. 構造特性
3.化学組成
4.分類
5.合成
6. 物理化学的性質
7.毒性
8. 抗菌活性
9. レオロジー特性
10. 化粧品業界への応用
11. 日常の化粧品への応用
アミノ酸界面活性剤 (AAS)疎水性基と1つ以上のアミノ酸を組み合わせることによって形成される界面活性剤のクラスです。この場合、アミノ酸は合成、またはタンパク質加水分解物または同様の再生可能な資源から得られます。この論文では、AAS の利用可能な合成経路のほとんどの詳細と、溶解度、分散安定性、毒性、生分解性など、最終製品の物理化学的特性に対するさまざまな経路の影響について説明します。需要が高まっている界面活性剤のクラスとして、その可変構造による AAS の汎用性は、多数の商業的機会を提供します。
界面活性剤が洗剤、乳化剤、腐食防止剤、三次石油回収、医薬品に広く使用されていることを考えると、研究者は界面活性剤に注意を払うことをやめたことはありません。
界面活性剤は、世界中で日常的に大量に消費され、水環境に悪影響を及ぼしてきた最も代表的な化学製品です。調査によると、従来の界面活性剤の広範な使用が環境に悪影響を及ぼす可能性があることが示されています。
今日、非毒性、生分解性、および生体適合性は、消費者にとって、界面活性剤の有用性および性能とほぼ同じくらい重要です。
バイオサーファクタントは、細菌、真菌、酵母などの微生物によって自然に合成されるか、細胞外に分泌される環境にやさしい持続可能な界面活性剤です。したがって、バイオサーファクタントは、リン脂質、アルキルグリコシド、アシルアミノ酸などの天然の両親媒性構造を模倣する分子設計によって調製することもできます。
アミノ酸界面活性剤(AAS)は代表的な界面活性剤の 1 つで、通常は動物由来または農業由来の原材料から製造されます。過去 20 年間、AAS は再生可能な資源から合成できるという理由だけでなく、AAS は容易に分解され、無害な副産物を持ち、環境にとってより安全であるため、新しい界面活性剤として科学者から大きな関心を集めてきました。環境。
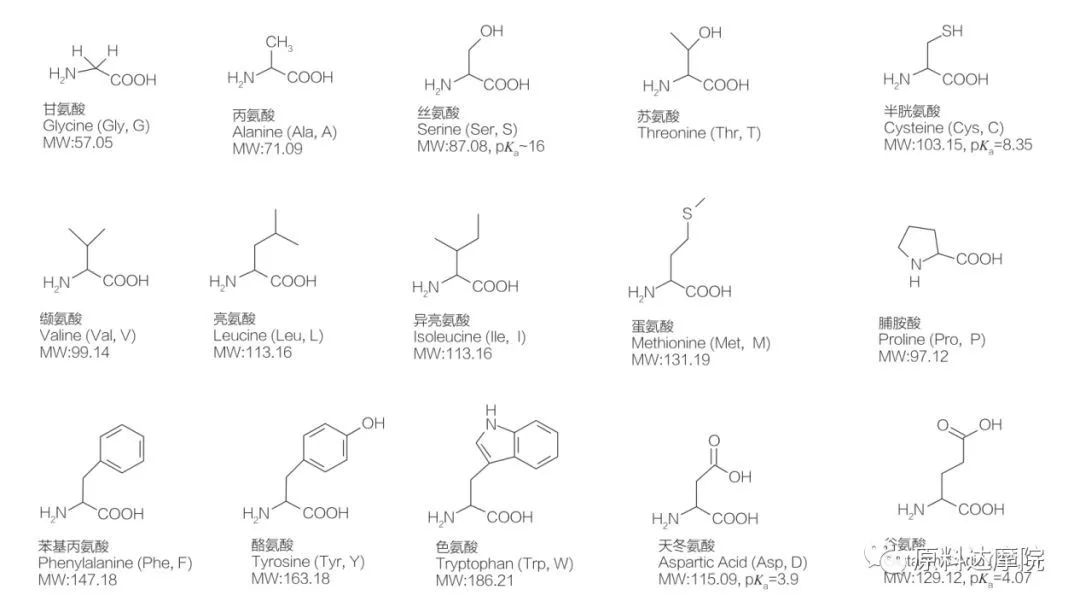
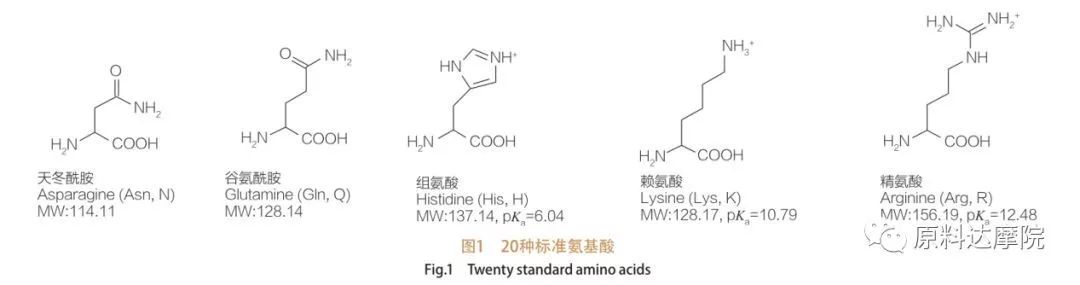
AAS は、アミノ酸基 (HO 2 C-CHR-NH 2) またはアミノ酸残基 (HO 2 C-CHR-NH-) を含むアミノ酸からなる界面活性剤のクラスとして定義できます。アミノ酸の 2 つの機能領域により、多種多様な界面活性剤の誘導が可能になります。合計 20 種類の標準タンパク質構成アミノ酸が自然界に存在することが知られており、成長および生命活動におけるすべての生理学的反応を担っています。それらは、残基 R によってのみ互いに異なります (図 1、pk a は、溶液の酸解離定数の負の対数です)。非極性で疎水性のもの、極性で親水性のもの、塩基性のもの、酸性のものなどがあります。
アミノ酸は再生可能な化合物であるため、アミノ酸から合成された界面活性剤は、持続可能で環境に優しいものになる可能性も高くなります。シンプルで自然な構造、低毒性、迅速な生分解性により、多くの場合、従来の界面活性剤よりも優れています。再生可能な原材料 (アミノ酸や植物油など) を使用して、AAS はさまざまなバイオテクノロジー ルートおよび化学ルートで生成できます。
20 世紀初頭、アミノ酸は界面活性剤合成の基質として使用されることが初めて発見されました。AAS は、主に医薬品および化粧品の防腐剤として使用されていました。さらに、AAS は、さまざまな病気の原因となる細菌、腫瘍、およびウイルスに対して生物学的に活性であることがわかっています。1988 年、低コストの AAS が利用できるようになったことで、表面活性に対する研究の関心が高まりました。今日、バイオテクノロジーの発展に伴い、一部のアミノ酸は酵母によって大規模に商業的に合成することもできます。これは、AAS 生産がより環境に優しいことを間接的に証明しています.
01 アミノ酸の開発
天然アミノ酸が最初に発見された 19 世紀初頭には、その構造は非常に価値があり、両親媒性物質を調製するための原料として使用できると予測されていました。AAS の合成に関する最初の研究は、1909 年にボンディによって報告されました。
その研究では、N-アシルグリシンと N-アシルアラニンが界面活性剤の親水基として導入されました。その後の研究では、グリシンとアラニンを使用したリポアミノ酸 (AAS) の合成が行われ、Hentrich ら.一連の調査結果を発表し、これには、家庭用クリーニング製品 (シャンプー、洗剤、歯磨き粉など) の界面活性剤としてのアシル サルコシネートおよびアシル アスパラギン酸塩の使用に関する最初の特許出願が含まれます。その後、多くの研究者がアシルアミノ酸の合成と物理化学的性質を調査しました。現在までに、AAS の合成、特性、産業用途、および生分解性に関する多数の文献が公開されています。
02 構造特性
AAS の非極性疎水性脂肪酸鎖は、構造、鎖長、および数が異なる場合があります。AAS の構造の多様性と高い表面活性は、それらの広範な組成の多様性と物理化学的および生物学的特性を説明しています。AAS のヘッド グループは、アミノ酸またはペプチドで構成されます。ヘッド グループの違いは、これらの界面活性剤の吸着、凝集、および生物学的活性を決定します。次に、ヘッド グループの官能基によって、カチオン性、アニオン性、非イオン性、両性などの AAS のタイプが決定されます。親水性のアミノ酸と疎水性の長鎖部分の組み合わせにより、両親媒性構造が形成され、分子の表面活性が高くなります。さらに、分子内の不斉炭素原子の存在は、キラル分子の形成に役立ちます。
03 化学組成
すべてのペプチドとポリペプチドは、これらの約 20 種類のα-タンパク質生成α-アミノ酸の重合生成物です。20種類のα-アミノ酸はすべて、カルボン酸官能基(-COOH)とアミノ官能基(-NH 2)を含み、両方とも同じ四面体α-炭素原子に結合しています。アミノ酸は、α-炭素に結合した異なる R 基によって互いに異なります (R 基が水素であるリシンを除く)。R 基は、構造、サイズ、および電荷 (酸性度、アルカリ度) が異なる場合があります。これらの違いは、アミノ酸の水への溶解度も決定します。
アミノ酸はキラル (グリシンを除く) であり、アルファ炭素に結合した 4 つの異なる置換基を持っているため、本質的に光学活性です。アミノ酸には 2 つの立体配座があります。L-立体異性体の数がかなり多いという事実にもかかわらず、それらは互いに重複しない鏡像です。一部のアミノ酸 (フェニルアラニン、チロシン、トリプトファン) に存在する R 基はアリールであり、280 nm で最大の UV 吸収をもたらします。アミノ酸中の酸性α-COOHと塩基性α-NH 2 はイオン化することができ、両方の立体異性体は、どちらであっても、以下に示すイオン化平衡を構築します。
R-COOH ↔R-COO-+H+
R-NH3+↔R-NH2+H+
上記のイオン化平衡に示されているように、アミノ酸には少なくとも 2 つの弱酸性基が含まれています。ただし、カルボキシル基は、プロトン化されたアミノ基と比較してはるかに酸性です。pH 7.4 では、カルボキシル基が脱プロトン化され、アミノ基がプロトン化されます。イオン化不可能な R 基を持つアミノ酸は、この pH では電気的に中性であり、両性イオンを形成します。
04 分類
AAS は、以下で順番に説明する 4 つの基準に従って分類できます。
4.1 由来による
| AASはその由来により、以下のように2つに分類できます。 ①ナチュラルカテゴリー アミノ酸を含む天然化合物の中には、表面/界面張力を低下させる能力もあり、糖脂質の有効性を超えるものもあります.これらの AAS は、リポペプチドとしても知られています。リポペプチドは低分子量の化合物で、通常はバチルス種によって生成されます。
このような AAS は、さらに 3 つのサブクラスに分類されます。サーファクチン、イツリン、フェンギシン。
|
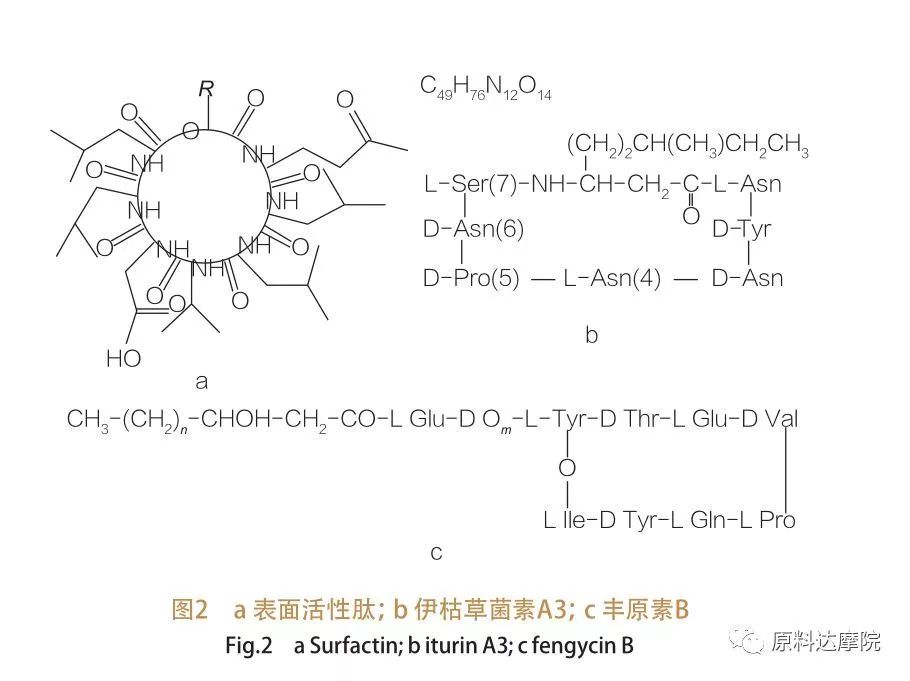
| 表面活性ペプチドのファミリーには、さまざまな物質のヘプタペプチド変異体が含まれます。図 2a に示すように、C12 ~ C16 の不飽和β-ヒドロキシ脂肪酸鎖がペプチドに結合しています。表面活性ペプチドは大環状ラクトンであり、β-ヒドロキシ脂肪酸のC末端とペプチドの間の触媒作用によって環が閉じられています。 イツリンのサブクラスには、6 つの主要なバリアント、すなわち、イツリン A と C、ミコサブチリン、バシロマイシン D、F、L があります。すべての場合において、ヘプタペプチドは、β-アミノ脂肪酸の C14-C17 鎖に結合しています (鎖は多様である可能性があります)。エクリマイシンの場合、β位のアミノ基はC末端とアミド結合を形成し、大環状ラクタム構造を形成します。
フェンギシンのサブクラスにはフェンギシン A と B が含まれており、Tyr9 が D 構成の場合、これらはプリパスタチンとも呼ばれます。デカペプチドは、C14~C18の飽和または不飽和のβ-ヒドロキシ脂肪酸鎖に結合している。構造的には、プリパスタチンは大環状ラクトンでもあり、ペプチド配列の 3 位に Tyr 側鎖を含み、C 末端残基とエステル結合を形成して内部環構造を形成します (多くのシュードモナス リポペプチドの場合と同様)。
②合成部門 AAS は、酸性、塩基性、中性アミノ酸のいずれかを使用して合成することもできます。AAS の合成に使用される一般的なアミノ酸は、グルタミン酸、セリン、プロリン、アスパラギン酸、グリシン、アルギニン、アラニン、ロイシン、およびタンパク質加水分解物です。このサブクラスの界面活性剤は、化学的、酵素的、および化学酵素的方法によって調製できます。ただし、AAS の生産では、化学合成の方が経済的に実現可能です。一般的な例には、N-ラウロイル-L-グルタミン酸および N-パルミトイル-L-グルタミン酸が含まれます。
|
4.2 脂肪族鎖置換基に基づく
脂肪族鎖置換基に基づいて、アミノ酸ベースの界面活性剤は2つのタイプに分けることができます。
置換基の位置による
| ①N置換AAS N-置換化合物では、アミノ基が親油性基またはカルボキシル基に置き換えられ、塩基性が失われます。N-置換 AAS の最も単純な例は N-アシル アミノ酸であり、これは本質的にアニオン性界面活性剤です。n-置換 AAS は、疎水性部分と親水性部分の間にアミド結合が結合しています。アミド結合には水素結合を形成する能力があり、酸性環境でこの界面活性剤の分解を促進し、生分解性にします。
②C置換AAS C置換化合物では、置換はカルボキシル基で(アミド結合またはエステル結合を介して)発生します。典型的なC置換化合物(例えば、エステルまたはアミド)は、本質的に陽イオン界面活性剤である。
③N-およびC-置換AAS このタイプの界面活性剤では、アミノ基とカルボキシル基の両方が親水性部分です。このタイプは本質的に両性界面活性剤です。 |
4.3 疎水性テイルの数による
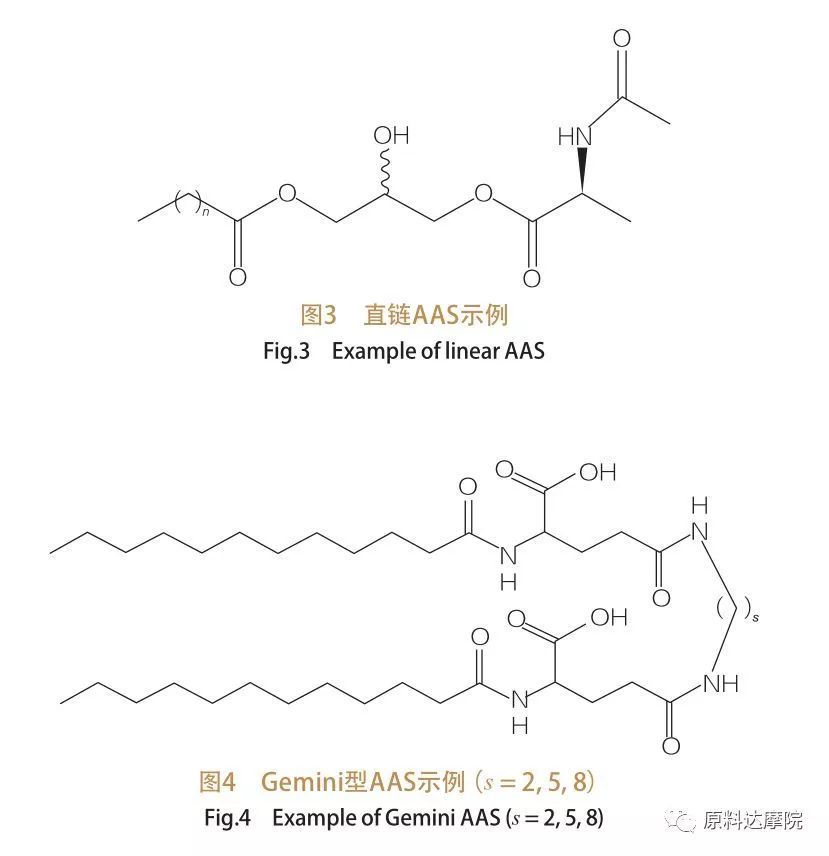
頭のグループと疎水性の尾の数に基づいて、AAS は 4 つのグループに分けることができます。直鎖型 AAS、ジェミニ (二量体) 型 AAS、グリセロ脂質型 AAS、双頭両親媒性 (ボーラ) 型 AAS。直鎖界面活性剤は、疎水性の尾部が 1 つだけあるアミノ酸からなる界面活性剤です (図 3)。ジェミニ型 AAS には、1 分子あたり 2 つのアミノ酸極性ヘッド グループと 2 つの疎水性テールがあります (図 4)。このタイプの構造では、2 つの直鎖 AAS がスペーサーによって連結されているため、ダイマーとも呼ばれます。一方、グリセロ脂質タイプの AAS では、2 つの疎水性テールが同じアミノ酸ヘッド グループに結合しています。これらの界面活性剤は、モノグリセリド、ジグリセリド、およびリン脂質の類似体と見なすことができますが、Bola 型 AAS では、2 つのアミノ酸ヘッド グループが疎水性テールによって結合されています。
4.4 ヘッドグループの種類による
①カチオンAAS
このタイプの界面活性剤の頭部基は正電荷を持っています。最も初期のカチオン性 AAS は、ピロリドン カルボキシレートであるココイル アルギン酸エチルです。この界面活性剤のユニークで多様な特性は、消毒剤、抗菌剤、帯電防止剤、ヘアコンディショナーに有用であるだけでなく、目や肌にやさしく、容易に生分解されます。Singare と Mhatre は、アルギニンベースのカチオン性 AAS を合成し、その物理化学的特性を評価しました。この研究では、彼らは Schotten-Baumann 反応条件を使用して得られた生成物の高収率を主張しました。アルキル鎖の長さと疎水性が増加すると、界面活性剤の表面活性が増加し、臨界ミセル濃度 (cmc) が減少することがわかりました。もう1つは、ヘアケア製品のコンディショナーとして一般的に使用されている第4級アシルタンパク質です.
②アニオンAAS
陰イオン界面活性剤では、界面活性剤の極性ヘッド基は負電荷を持っています。サルコシン (CH 3 -NH-CH 2 -COOH、N-メチルグリシン) は、ウニやヒトデによく見られるアミノ酸で、塩基性アミノ酸であるグリシン (NH 2 -CH 2 -COOH) と化学的に関連しています。哺乳類細胞で。-COOH,) は、哺乳動物細胞に見られる塩基性アミノ酸であるグリシンと化学的に関連しています。ラウリン酸、テトラデカン酸、オレイン酸、およびそれらのハロゲン化物とエステルは、サルコシネート界面活性剤の合成に一般的に使用されます。サルコシネートは本質的に刺激が少ないため、うがい薬、シャンプー、シェービング フォームのスプレー、日焼け止め、スキン クレンザー、その他の化粧品に広く使用されています。
他の市販のアニオン性AASには、それぞれN-ココイル-L-グルタミン酸ナトリウムおよびN-ココイルグリシン酸カリウムの商品名であるAmisoft CS-22およびAmiliteGCK-12が含まれる。アミライトは、発泡剤、洗浄剤、可溶化剤、乳化剤、分散剤として一般的に使用されており、シャンプー、バスソープ、ボディウォッシュ、歯磨き粉、洗顔料、クレンジングソープ、コンタクトレンズクリーナー、家庭用界面活性剤などの化粧品に多くの用途があります。アミソフトはマイルドな肌と髪のクレンザーとして、主に洗顔料とボディクレンザー、ブロック合成洗剤、ボディケア製品、シャンプー、その他のスキンケア製品に使用されています。
③両性イオンまたは両性AAS
両性界面活性剤は、酸性部位と塩基性部位の両方を含むため、pH 値を変えることで電荷を変えることができます。アルカリ性媒体では陰イオン界面活性剤のように振る舞い、酸性環境では陽イオン界面活性剤のように振る舞い、中性媒体では両性界面活性剤のように振る舞います。ラウリルリジン (LL) とアルコキシ (2-ヒドロキシプロピル) アルギニンは、アミノ酸に基づく唯一の既知の両性界面活性剤です。LLはリジンとラウリン酸の縮合生成物です。両性構造のため、LL は、非常にアルカリ性または酸性の溶媒を除いて、ほとんどすべての種類の溶媒に不溶です。有機粉末として、LL は親水性表面への優れた接着性と低い摩擦係数を持ち、この界面活性剤に優れた潤滑能力を与えます。LLは、スキンクリームやヘアコンディショナーに広く使用されており、潤滑剤としても使用されています.
④ノニオンAAS
非イオン性界面活性剤は、正式な電荷を持たない極性ヘッド グループによって特徴付けられます。8 つの新しいエトキシル化非イオン性界面活性剤は、Al-Sabagh らによって調製されました。油溶性α-アミノ酸から。このプロセスでは、L-フェニルアラニン (LEP) と L-ロイシンを最初にヘキサデカノールでエステル化し、続いてパルミチン酸でアミド化して、α-アミノ酸の 2 つのアミドと 2 つのエステルを生成しました。次に、アミドとエステルをエチレンオキシドと縮合反応させて、異なる数のポリオキシエチレン単位(40、60、および100)を持つ3つのフェニルアラニン誘導体を調製しました。これらの非イオン性 AAS は、優れた洗浄力と起泡性を備えていることがわかりました。
05 合成
5.1 基本合成経路
AAS では、疎水基をアミンまたはカルボン酸部位に結合させるか、アミノ酸の側鎖を介して結合させることができます。これに基づいて、図 5 に示すように、4 つの基本的な合成ルートが利用可能です。
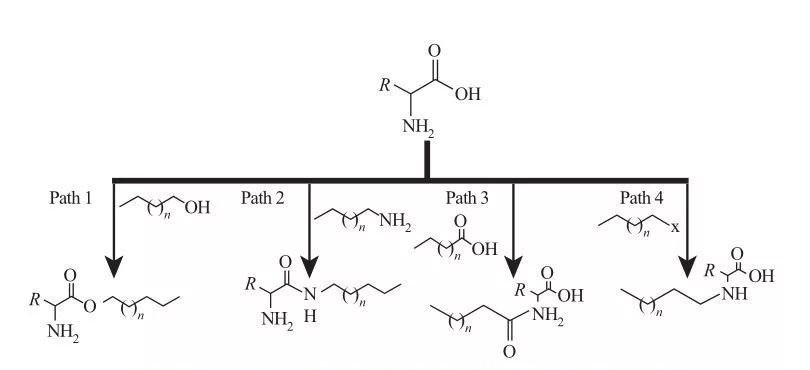
図5 アミノ酸系界面活性剤の基本的な合成経路
| 経路 1。 両親媒性エステルアミンは、エステル化反応によって生成されます。この場合、界面活性剤の合成は通常、脱水剤と酸性触媒の存在下で脂肪アルコールとアミノ酸を還流することによって行われます。一部の反応では、硫酸は触媒と脱水剤の両方として機能します。
経路 2。 活性化アミノ酸はアルキルアミンと反応してアミド結合を形成し、両親媒性アミドアミンを合成します。
経路 3。 アミド酸は、アミノ酸のアミン基をアミド酸と反応させることによって合成されます。
経路 4。 長鎖アルキルアミノ酸は、アミン基とハロアルカンとの反応によって合成されました。 |
5.2 合成と生産の進歩
5.2.1 単鎖アミノ酸/ペプチド界面活性剤の合成
N-アシルまたはO-アシルのアミノ酸またはペプチドは、脂肪酸によるアミンまたはヒドロキシル基の酵素触媒アシル化によって合成することができます。アミノ酸アミドまたはメチルエステル誘導体の無溶媒リパーゼ触媒合成に関する最も初期の報告では、Candida antarctica が使用され、収率は標的アミノ酸に応じて 25% から 90% の範囲でした。メチルエチルケトンは、一部の反応で溶媒としても使用されています。ボンダーハーゲン等。また、水と有機溶媒の混合物(例えば、ジメチルホルムアミド/水)とメチルブチルケトンを使用した、アミノ酸、タンパク質加水分解物、および/またはそれらの誘導体のリパーゼおよびプロテアーゼ触媒N-アシル化反応についても説明しました。
初期の AAS の酵素触媒による合成の主な問題は、収率が低いことでした。Valivetyらによると。N-テトラデカノイルアミノ酸誘導体の収率は、異なるリパーゼを使用し、70°Cで何日もインキュベートした後でも、わずか2%~10%でした。モンテら。また、脂肪酸と植物油を使用した N-アシル リジンの合成では、アミノ酸の収率が低いという問題に遭遇しました。彼らによると、生成物の最大収率は、無溶媒および有機溶媒を使用した条件で 19% でした。Valivety らも同じ問題に遭遇した。N-Cbz-L-リジンまたはN-Cbz-リジンメチルエステル誘導体の合成。
この研究では、N-保護セリンを基質として使用し、Novozyme 435 を触媒として溶融溶媒のない環境で使用した場合、3-O-テトラデカノイル-L-セリンの収率は 80% であると主張しました。長尾と鬼頭は、リパーゼを使用した場合の L-セリン、L-ホモセリン、L-スレオニン、L-チロシン (LET) の O-アシル化を研究しました。 L-ホモセリンと L-セリンのアシル化の収率はやや低いが、L-スレオニンと LET のアシル化は起こらなかったと報告している。
多くの研究者は、費用対効果の高い AAS の合成のための安価で入手しやすい基質の使用を支持してきました。スーら。ヤシ油ベースの界面活性剤の調製は、固定化リポ酵素で最も効果的であると主張しました.彼らは、時間のかかる反応 (6 日間) にもかかわらず、生成物の収率が向上することに注目しました。ゲロバ等。環状/ラセミ混合物中のメチオニン、プロリン、ロイシン、スレオニン、フェニルアラニン、およびフェニルグリシンに基づくキラルN-パルミトイルAASの合成と表面活性を調査しました。Pang と Chu は、溶液中のアミノ酸ベースのモノマーとジカルボン酸ベースのモノマーの合成について説明しました。一連の機能的で生分解性のアミノ酸ベースのポリアミドエステルは、溶液中での共縮合反応によって合成されました。
Cantaeuzene と Guerreiro は、Boc-Ala-OH と Boc-Asp-OH のカルボン酸基を長鎖脂肪族アルコールとジオールでエステル化し、ジクロロメタンを溶媒として、アガロース 4B (セファロース 4B) を触媒としてエステル化することを報告しました。この研究では、Boc-Ala-OH と炭素数 16 までの脂肪族アルコールとの反応で良好な収率 (51%) が得られましたが、Boc-Asp-OH では炭素数 6 および 12 の方が良好で、対応する収率は 63% でした [64 ]。これらは、パパインが触媒として作用する Cbz-Arg-OMe によって、さまざまな長鎖アルキルアミンとのアミド結合または脂肪族アルコールとのエステル結合の形成によって合成されました。
5.2.2 ジェミニベースのアミノ酸/ペプチド界面活性剤の合成
アミノ酸ベースのジェミニ界面活性剤は、2 つの直鎖 AAS 分子がスペーサー基によって互いに頭と頭を結び付けたもので構成されています。ジェミニ型アミノ酸ベースの界面活性剤の化学酵素合成には、2 つの可能なスキームがあります (図 6 および 7)。図6では、2つのアミノ酸誘導体がスペーサー基として化合物と反応し、その後2つの疎水基が導入されています。図 7 では、2 つの直鎖構造が二官能性スペーサー基によって直接連結されています。
ジェミニリポアミノ酸の酵素触媒合成の最も初期の開発は、Valivety らによって開拓されました。吉村ら。シスチンとn-アルキルブロマイドに基づくアミノ酸ベースのジェミニ界面活性剤の合成、吸着、および凝集を調査しました。合成された界面活性剤は、対応する単量体界面活性剤と比較されました。ファウスティーノ等。L-シスチン、D-シスチン、DL-シスチン、L-システイン、L-メチオニン、L-スルホアラニン、およびそれらのジェミニのペアに基づくアニオン性尿素ベースのモノマーAASの合成を、伝導性、平衡表面張力、および安定性によって説明しました-それらの状態蛍光特性。モノマーとジェミニを比較することにより、ジェミニのcmc値が低いことが示されました。
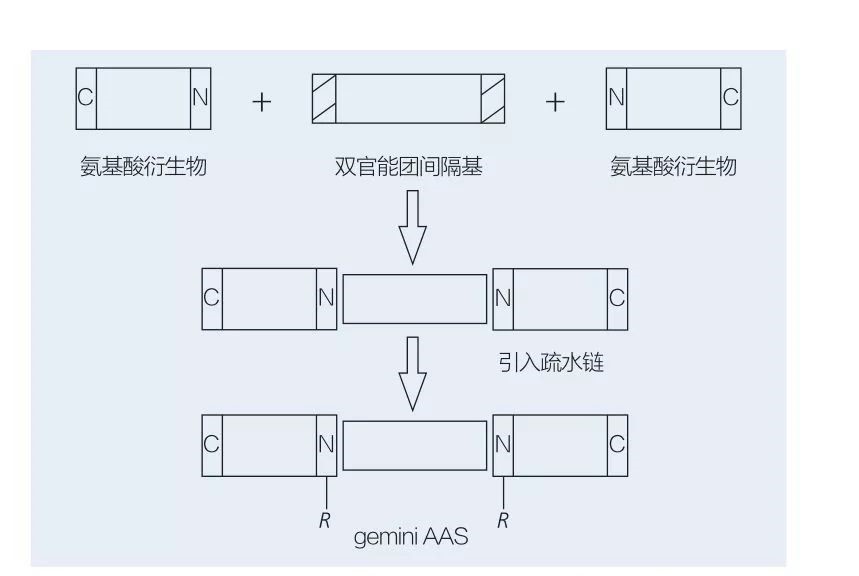
図 6 AA 誘導体とスペーサーを使用したジェミニ AAS の合成、続いて疎水性基の挿入
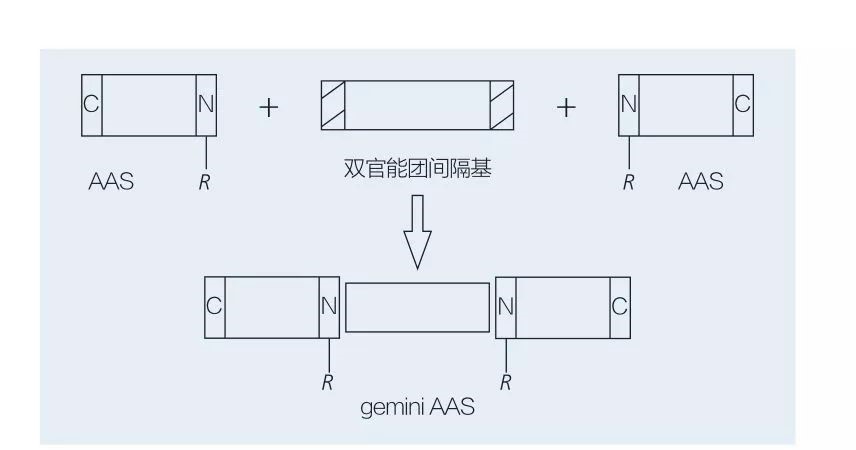
図 7 二官能性スペーサーと AAS を使用したジェミニ AAS の合成
5.2.3 グリセロ脂質アミノ酸・ペプチド界面活性剤の合成
グリセロ脂質アミノ酸/ペプチド界面活性剤は、グリセロール骨格に結合した1つのアミノ酸を持つ1つまたは2つの脂肪鎖の構造により、グリセロールモノ(またはジ)エステルおよびリン脂質の構造類似体である脂質アミノ酸の新しいクラスです。エステル結合による。これらの界面活性剤の合成は、酸性触媒(例えばBF 3 )の存在下、高温でアミノ酸のグリセロールエステルを調製することから始まります。酵素触媒による合成 (加水分解酵素、プロテアーゼ、リパーゼを触媒として使用) も良い選択肢です (図 8)。
パパインを用いたジラウリル化アルギニングリセリド複合体の酵素触媒合成が報告されています。アセチルアルギニンからのジアシルグリセロールエステルコンジュゲートの合成およびそれらの物理化学的特性の評価も報告されています。
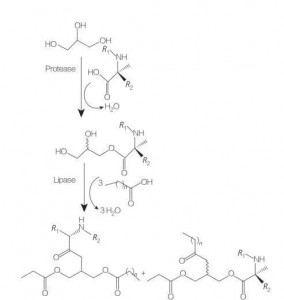
Fig.8 モノおよびジアシルグリセロールアミノ酸コンジュゲートの合成
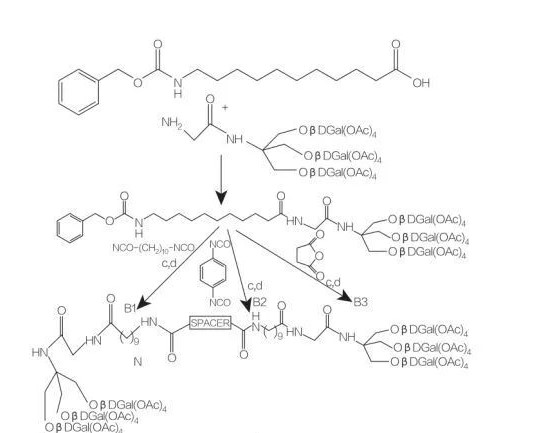
スペーサー:NH-(CH2)10-NH: 化合物B1
スペーサー:NH-C6H4-NH: 化合物B2
スペーサー:CH2-CH2:化合物B3
Fig.9 トリス(ヒドロキシメチル)アミノメタン由来の対称両親媒性物質の合成
5.2.4 ボラベースのアミノ酸/ペプチド界面活性剤の合成
アミノ酸ベースのボーラ型両親媒性物質には、同じ疎水性鎖に結合した 2 つのアミノ酸が含まれています。フランチェスキ等。2つのアミノ酸(D-またはL-アラニンまたはL-ヒスチジン)と異なる長さの1つのアルキル鎖を持つボーラ型両親媒性物質の合成について説明し、それらの表面活性を調査しました。彼らは、アミノ酸画分 (珍しいβ-アミノ酸またはアルコールのいずれかを使用) および C12 -C20 スペーサー基を使用した新規のボーラ型両親媒性物質の合成と凝集について説明しています。使用される珍しいβ-アミノ酸は、糖アミノ酸、アジドチミン(AZT)由来のアミノ酸、ノルボルネンアミノ酸、およびAZT由来のアミノアルコールです(図9).トリス(ヒドロキシメチル)アミノメタン(Tris)に由来する対称ボラ型両親媒性物質の合成(図9)。
06 物理化学的性質
アミノ酸ベースの界面活性剤 (AAS) は本質的に多様で用途が広く、良好な可溶化、良好な乳化特性、高効率、高表面活性性能、硬水 (カルシウムイオン許容範囲)。
アミノ酸の界面活性特性 (表面張力、cmc、相挙動、クラフト温度など) に基づいて、広範な研究の結果、次の結論に達しました。
6.1 臨界ミセル濃度 (cmc)
臨界ミセル濃度は、界面活性剤の重要なパラメーターの 1 つであり、可溶化、細胞溶解、バイオフィルムとの相互作用など、多くの表面活性特性を支配します。したがって、界面活性剤溶液のcmc値が増加し、その表面活性が増加します。アミノ酸に基づく界面活性剤は、通常、従来の界面活性剤と比較して低い cmc 値を持っています。
ヘッドグループと疎水性テール(モノカチオンアミド、バイカチオンアミド、バイカチオンアミドベースのエステル)のさまざまな組み合わせにより、Infante et al。3つのアルギニンベースのAASを合成し、それらのcmcおよびγcmc(cmcでの表面張力)を調べたところ、cmcおよびγcmcの値が疎水性テールの長さの増加とともに減少したことが示されました。別の研究で、Singare と Mhatre は、N-α-アシルアルギニン界面活性剤の cmc が、疎水性テール炭素原子の数の増加とともに減少することを発見しました (表 1)。
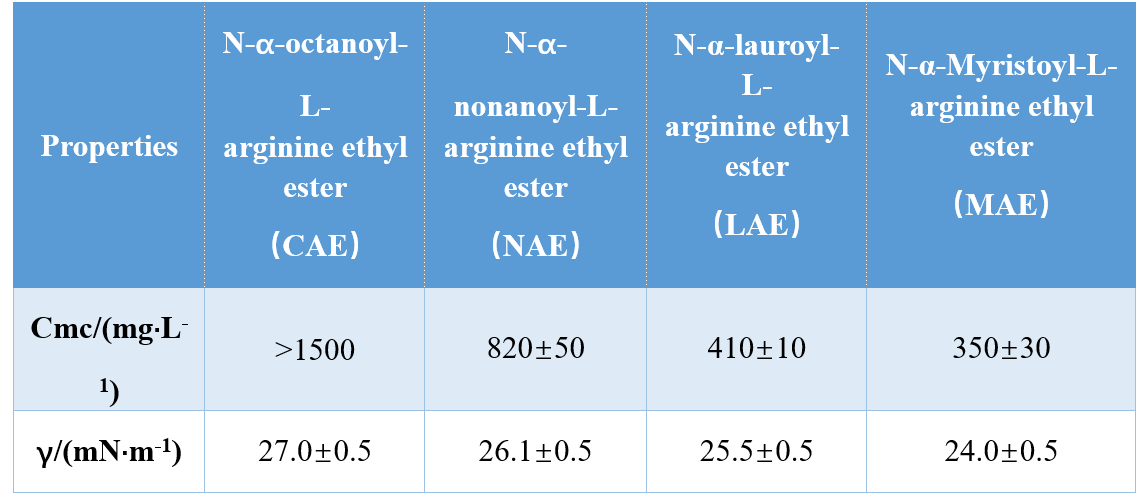
吉村ら。システイン由来のアミノ酸ベースのジェミニ界面活性剤のcmcを調査し、疎水性鎖の炭素鎖長が10から12に増加するとcmcが減少することを示しました.炭素鎖長を14にさらに増加させると、cmcが増加し、長鎖ジェミニ界面活性剤は凝集する傾向が低いことが確認されました。
ファウスティーノ等。シスチンに基づくアニオン性ジェミニ界面活性剤の水溶液中の混合ミセルの形成を報告しました。ジェミニ界面活性剤は、対応する従来の単量体界面活性剤 (C 8 Cys) とも比較されました。脂質界面活性剤混合物の cmc 値は、純粋な界面活性剤の値よりも低いことが報告されています。ジェミニ界面活性剤および水溶性のミセル形成リン脂質である1,2-ジヘプタノイル-sn-グリセリル-3-ホスホコリンは、ミリモルレベルのcmcを持っていました。
Shrestha と Aramaki は、混合塩の非存在下で、混合アミノ酸ベースの陰イオン-非イオン界面活性剤の水溶液における粘弾性のミミズ状ミセルの形成を調査しました。この研究では、N-ドデシル グルタミン酸のクラフト温度が高いことがわかりました。しかし、塩基性アミノ酸である L-リジンで中和すると、ミセルが生成され、溶液は 25 °C でニュートン流体のように振る舞い始めました。
6.2 良好な水溶性
AAS の優れた水溶性は、追加の CO-NH 結合の存在によるものです。これにより、AAS は対応する従来の界面活性剤よりも生分解性が高く、環境に優しいものになります。N-アシル-L-グルタミン酸の水溶性は、2 つのカルボキシル基によりさらに優れています。Cn(CA) 2 の水溶性も良好です。これは、1 分子中に 2 つのイオン性アルギニン基があるためです。これにより、細胞界面での吸着と拡散がより効果的になり、低濃度でも効果的な細菌抑制が行われます。
6.3 クラフト温度とクラフト点
クラフト温度は、特定の温度を超えると溶解度が急激に増加する界面活性剤の特定の溶解挙動として理解できます。イオン性界面活性剤は、水から沈殿する可能性のある固体水和物を生成する傾向があります。特定の温度 (いわゆるクラフト温度) では、通常、界面活性剤の溶解度の劇的かつ不連続な増加が観察されます。イオン性界面活性剤のクラフト点は、cmc でのクラフト温度です。
この溶解特性は、通常、イオン性界面活性剤で見られ、次のように説明できます。界面活性剤を含まないモノマーの溶解度は、ミセル形成により溶解度が徐々に増加するクラフト点に達するまで、クラフト温度未満に制限されます。完全な溶解性を確保するには、クラフト点を超える温度で界面活性剤配合物を調製する必要があります。
AAS のクラフト温度が研究され、従来の合成界面活性剤のクラフト温度と比較されました。Shrestha と Aramaki は、アルギニンベースの AAS のクラフト温度を研究し、臨界ミセル濃度が 2 ~ 5 以上のプレミセルの形で凝集挙動を示すことを発見しました。 ×10-6 mol-L -1 に続いて通常のミセルが形成されます (Ohta et al. は 6 種類の N-ヘキサデカノイル AAS を合成し、それらのクラフト温度とアミノ酸残基の関係を議論しました。
実験では、N-ヘキサデカノイル AAS のクラフト温度はアミノ酸残基のサイズの減少に伴い上昇し (フェニルアラニンは例外)、溶解熱 (熱吸収) はアミノ酸残基のサイズの減少に伴い増加することがわかりました (グリシンとフェニルアラニンを除く)。アラニン系とフェニルアラニン系の両方で、DL 相互作用は、N-ヘキサデカノイル AAS 塩の固体形態での LL 相互作用よりも強いと結論付けられました。
ブリト等。示差走査マイクロ熱量計を使用して 3 つの一連の新規アミノ酸ベースの界面活性剤のクラフト温度を決定し、トリフルオロ酢酸イオンをヨウ化物イオンに変更すると、クラフト温度が 47 °C から 53 °C に大幅に上昇する (約 6 °C) ことを発見しました。 C.cis 二重結合の存在と長鎖 Ser 誘導体に存在する不飽和により、クラフト温度が大幅に低下しました。n-ドデシル グルタミン酸は、より高いクラフト温度を持つことが報告されました。しかし、塩基性アミノ酸の L-リジンで中和すると、25 °C でニュートン流体のように振る舞う溶液中のミセルが形成されました。
6.4 表面張力
界面活性剤の表面張力は、疎水性部分の鎖長に関連しています。張ら。ココイルグリシンナトリウムの表面張力をウィルヘルミープレート法(25±0.2)℃で測定し、cmcでの表面張力値を33 mN-m -1 、cmcで0.21 mmol-L -1 と測定した。吉村ら。2C n Cys系アミノ酸系界面活性剤の表面張力を決定した。cmc での表面張力は鎖長の増加に伴い (n = 8 まで) 減少することがわかりましたが、n = 12 以上の鎖長を持つ界面活性剤では傾向が逆転しました。
ジカルボキシル化アミノ酸系界面活性剤の表面張力に対するCaCl 2 の効果も研究されている。これらの研究では、CaCl 2 を 3 つのジカルボキシル化アミノ酸型界面活性剤 (C12 MalNa 2、C12 AspNa 2、および C12 GluNa 2) の水溶液に添加しました。cmc 後のプラトー値を比較すると、非常に低い CaCl 2 濃度で表面張力が低下することがわかりました。これは、気水界面での界面活性剤の配置に対するカルシウムイオンの影響によるものです。一方、N-ドデシルアミノマロネートと N-ドデシルアスパルテートの塩の表面張力も、10 mmol-L -1 CaCl 2 濃度までほぼ一定でした。10 mmol-L -1 を超えると、界面活性剤のカルシウム塩の沈殿が形成されるため、表面張力が急激に増加します。N-ドデシル グルタミン酸の二ナトリウム塩の場合、CaCl 2 を適度に添加すると、表面張力が大幅に低下しましたが、CaCl 2 濃度を継続的に増加させても、有意な変化は生じませんでした。
気水界面でのジェミニ型 AAS の吸着動力学を決定するために、最大気泡圧法を使用して動的表面張力を決定しました。結果は、最長の試験時間で、2C 12 Cys 動的表面張力が変化しなかったことを示しました。動的表面張力の減少は、濃度、疎水性尾の長さ、および疎水性尾の数のみに依存します。界面活性剤の濃度を上げ、鎖長と鎖の数を減らすと、より急速な減衰が起こりました。高濃度の C n Cys (n = 8 ~ 12) で得られた結果は、Wilhelmy 法によって測定された γ cmc に非常に近いことがわかりました。
別の研究では、ジラウリル シスチン ナトリウム (SDLC) とジデカミノ シスチン ナトリウムの動的表面張力が Wilhelmy プレート法によって決定され、さらに、それらの水溶液の平衡表面張力がドロップ ボリューム法によって決定されました。ジスルフィド結合の反応は、他の方法でもさらに調査されました。メルカプトエタノールを 0.1 mmol-L -1SDLC 溶液に添加すると、表面張力が 34 mN-m -1 から 53 mN-m -1 に急速に増加しました。NaClO は SDLC のジスルフィド結合をスルホン酸基に酸化できるため、NaClO (5 mmol-L -1 ) を 0.1 mmol-L -1 SDLC 溶液に添加した場合、凝集は観察されませんでした。透過型電子顕微鏡および動的光散乱の結果は、溶液中に凝集体が形成されていないことを示しました。SDLC の表面張力は、20 分間で 34 mN-m -1 から 60 mN-m -1 に増加することがわかりました。
6.5 二成分表面相互作用
生命科学では、多くのグループがカチオン性 AAS (ジアシルグリセロール アルギニン ベースの界面活性剤) とリン脂質の混合物の気水界面での振動特性を研究しており、最終的に、この非理想的な特性が静電相互作用の蔓延を引き起こすと結論付けています。
6.6 集計プロパティ
動的光散乱は、アミノ酸ベースのモノマーおよびジェミニ界面活性剤の cmc を超える濃度での凝集特性を決定するために一般的に使用され、見かけの流体力学的直径 DH (= 2R H ) をもたらします。C n Cys と 2Cn Cys によって形成される凝集体は比較的大きく、他の界面活性剤と比較して広いスケールの分布を持っています。2C 12 Cys を除くすべての界面活性剤は、通常、約 10 nm の凝集体を形成します。ジェミニ界面活性剤のミセル サイズは、対応する単量体のものよりも大幅に大きくなっています。炭化水素鎖の長さが長くなると、ミセルのサイズも大きくなります。太田ら。水溶液中のN-ドデシル-フェニル-アラニル-フェニル-アラニンテトラメチルアンモニウムの3つの異なる立体異性体の凝集特性を説明し、ジアステレオ異性体が水溶液で同じ臨界凝集濃度を持つことを示しました。岩橋ら。円偏光二色性、NMR、蒸気圧浸透圧計による調査 異なる溶媒 (テトラヒドロフラン、アセトニトリル、1,4円偏光二色性、NMR および蒸気圧浸透圧測定法により、回転特性を有する -ジオキサンおよび 1,2-ジクロロエタン) を調査しました。
6.7 界面吸着
アミノ酸ベースの界面活性剤の界面吸着と、その従来の対応物との比較も、研究の方向性の1つです。たとえば、LET および LEP から得られる芳香族アミノ酸のドデシルエステルの界面吸着特性が調査されました。その結果、LET と LEP は、それぞれ気液界面と水/ヘキサン界面でより低い界面面積を示すことが示されました。
ボルデス等。は、3 つのジカルボキシル化アミノ酸界面活性剤、ドデシル グルタミン酸、ドデシル アスパラギン酸、およびアミノマロン酸の二ナトリウム塩 (2 つのカルボキシル基の間にそれぞれ 3、2、および 1 の炭素原子を有する) の溶液挙動および気水界面での吸着を調査しました。この報告によると、ジカルボキシル化界面活性剤のcmcは、モノカルボキシル化ドデシルグリシン塩のcmcより4~5倍高かった。これは、ジカルボキシル化界面活性剤とそのアミド基を介した隣接分子との間の水素結合の形成に起因します。
6.8 相の挙動
非常に高濃度の界面活性剤では、等方性不連続キュービック相が観察されます。非常に大きな頭部基を持つ界面活性剤分子は、より小さな正の曲率の凝集体を形成する傾向があります。マルケスら。12Lys12/12Ser および 8Lys8/16Ser システムの相挙動を研究し (図 10 を参照)、結果は、12Lys12/12Ser システムがミセルと小胞溶液領域の間に相分離ゾーンを持っていることを示しましたが、8Lys8/16Ser システムは、 8Lys8/16Ser システムは、連続的な遷移 (小ミセル相領域とベシクル相領域の間の細長いミセル相領域) を示します。12Lys12/12Ser システムのベシクル領域では、ベシクルは常にミセルと共存していますが、8Lys8/16Ser システムのベシクル領域にはベシクルしかありません。
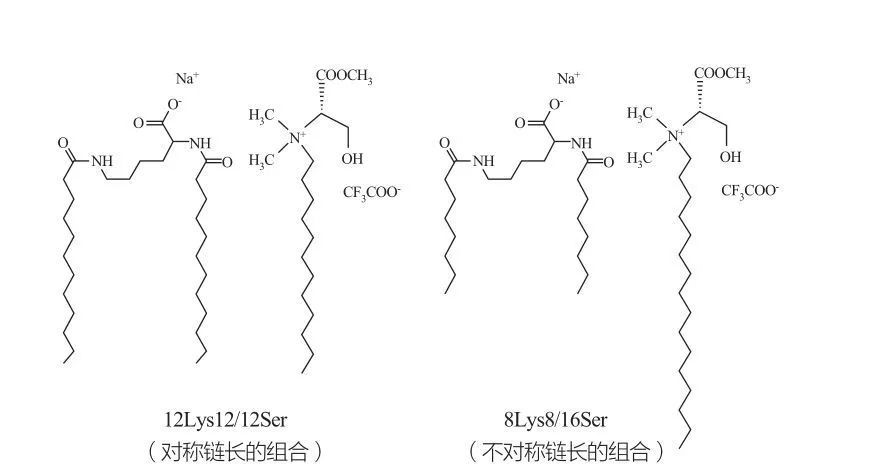
リジンおよびセリンベースの界面活性剤のカタニオン混合物: 対称 12Lys12/12Ser ペア (左) および非対称 8Lys8/16Ser ペア (右)
6.9 乳化力
高知ら。N-[3-ドデシル-2-ヒドロキシプロピル]-L-アルギニン、L-グルタミン酸、およびその他の AAS の乳化能力、界面張力、分散性、および粘度を調べました。合成界面活性剤(従来の非イオン性および両性対応物)と比較して、結果は、AASが従来の界面活性剤よりも強い乳化能力を有することを示しました。
Baczko等。新しいアニオン性アミノ酸界面活性剤を合成し、キラル配向NMR分光法溶媒としての適合性を調査しました。アミノ酸を無水 o-スルホ安息香酸と反応させることにより、一連の異なる疎水性尾部 (ペンチル~テトラデシル) を持つスルホン酸ベースの両親媒性 L-Phe または L-Ala 誘導体を合成しました。呉ら。N-脂肪酸アシルAASの合成ナトリウム塩およびは、水中油型エマルションでの乳化能力を調査し、その結果、これらの界面活性剤は、油相として n-ヘキサンを使用する場合よりも、油相として酢酸エチルを使用した場合の方が優れた性能を発揮することが示されました。
6.10 合成と生産の進歩
硬水耐性は、硬水中のカルシウムやマグネシウムなどのイオンの存在に抵抗する界面活性剤の能力、すなわち、カルシウム石鹸への沈殿を回避する能力として理解することができます。耐硬水性の高い界面活性剤は、洗剤の配合やパーソナルケア製品に非常に役立ちます。硬水耐性は、カルシウムイオンの存在下での界面活性剤の溶解度と表面活性の変化を計算することによって評価できます。
硬水耐性を評価する別の方法は、100 g のオレイン酸ナトリウムから形成されたカルシウム石鹸が水に分散するのに必要な界面活性剤のパーセンテージまたはグラムを計算することです。硬水が多い地域では、高濃度のカルシウムイオンとマグネシウムイオン、およびミネラル含有量により、実際の適用が困難になる場合があります。多くの場合、ナトリウムイオンは合成陰イオン界面活性剤の対イオンとして使用されます。二価カルシウムイオンは両方の界面活性剤分子に結合しているため、界面活性剤が溶液からより容易に沈殿し、洗浄力が低下する.
AAS の硬水耐性の研究は、酸および硬水耐性が追加のカルボキシル基によって強く影響され、酸および硬水耐性が 2 つのカルボキシル基間のスペーサー基の長さの増加とともにさらに増加することを示しました。 .耐酸性および耐水性の順序は、C 12 グリシン < C 12 アスパラギン酸 < C 12 グルタミン酸の順でした。ジカルボキシル化アミド結合とジカルボキシル化アミノ界面活性剤をそれぞれ比較すると、適切な量の酸の添加により、後者のpH範囲が広くなり、その表面活性が増加することがわかりました。ジカルボキシル化N-アルキルアミノ酸はカルシウムイオンの存在下でキレート効果を示し、C 12 アスパラギン酸は白色ゲルを形成した。c 12 グルタミン酸は、高 Ca 2+ 濃度で高い表面活性を示し、海水の淡水化に使用されることが期待されています。
6.11 分散性
分散性とは、溶液中の界面活性剤の合体および沈降を防止する界面活性剤の能力を指す。分散性は界面活性剤の重要な特性であり、洗剤、化粧品、医薬品への使用に適しています。分散剤は、疎水基と末端親水基の間(または直鎖疎水基の間)にエステル、エーテル、アミドまたはアミノ結合を含まなければならない。
一般に、硫酸アルカノールアミドなどの陰イオン性界面活性剤およびアミドスルホベタインなどの両性界面活性剤は、カルシウム石鹸の分散剤として特に有効である。
多くの研究努力により、AAS の分散性が確認されましたが、N-ラウロイル リジンは水との適合性が低く、化粧品の処方に使用するのが難しいことがわかりました。N-アシル基を置換した塩基性アミノ酸の分散性に優れたシリーズで、化粧品業界の処方改良に使用されています。
07 毒性
従来の界面活性剤、特にカチオン性界面活性剤は、水生生物に対して非常に有毒です。それらの急性毒性は、細胞と水の界面における界面活性剤の吸着イオン相互作用の現象によるものです。通常、界面活性剤の cmc を下げると、界面活性剤の界面吸着が強くなり、通常は急性毒性が高くなります。界面活性剤の疎水性鎖の長さの増加も、界面活性剤の急性毒性の増加につながります。ほとんどの AAS は、人間や環境 (特に海洋生物) に対して低毒性または無毒であり、食品成分、医薬品、化粧品としての使用に適しています。多くの研究者は、アミノ酸系界面活性剤が肌にやさしく、刺激がないことを証明しています。アルギニンベースの界面活性剤は、従来の対応物よりも毒性が低いことが知られています.
ブリト等。アミノ酸ベースの両親媒性物質の物理化学的および毒物学的特性と、それらの [チロシン (Tyr)、ヒドロキシプロリン (Hyp)、セリン (Ser)、およびリジン (Lys) からの誘導体] カチオン性小胞の自然形成を研究し、それらの急性毒性に関するデータを提供しました。ミジンコ (IC 50)。彼らは、臭化ドデシルトリメチルアンモニウム (DTAB)/Lys 誘導体および/または Ser/Lys 誘導体混合物のカチオン性ベシクルを合成し、それらの生態毒性と溶血能力をテストし、すべての AAS とそれらのベシクル含有混合物が従来の界面活性剤 DTAB よりも毒性が低いことを示しました。 .
ローザ等。安定したアミノ酸ベースのカチオン性小胞へのDNAの結合(会合)を調査しました。しばしば有毒であると思われる従来のカチオン性界面活性剤とは異なり、カチオン性アミノ酸界面活性剤の相互作用は無毒であると思われる.カチオン性 AAS はアルギニンに基づいており、特定のアニオン性界面活性剤と組み合わせて安定した小胞を自発的に形成します。アミノ酸ベースの腐食防止剤も無毒であると報告されています。これらの界面活性剤は、高純度 (最大 99%)、低コスト、生分解性が高く、水性媒体に完全に溶解して容易に合成できます。いくつかの研究は、硫黄含有アミノ酸界面活性剤が腐食防止に優れていることを示しています。
最近の研究では、Perinelli 等。従来の界面活性剤と比較して、ラムノリピドの満足のいく毒物学的プロファイルを報告しました。ラムノリピドは透過性エンハンサーとして作用することが知られています。彼らはまた、高分子薬物の上皮透過性に対するラムノリピドの効果を報告しました。
08 抗菌活性
界面活性剤の抗菌活性は、最小発育阻止濃度によって評価できます。アルギニンベースの界面活性剤の抗菌活性は、詳細に研究されています。グラム陰性菌は、グラム陽性菌よりもアルギニンベースの界面活性剤に対してより耐性があることがわかった.界面活性剤の抗菌活性は、通常、アシル鎖内のヒドロキシル、シクロプロパンまたは不飽和結合の存在によって増加します。カスティーヨ等。は、アシル鎖の長さと正電荷が分子の HLB 値 (親水性 - 親油性バランス) を決定し、これらが膜を破壊する能力に影響を与えることを示しました。Nα-アシルアルギニン メチル エステルは、広範囲の抗菌活性を持つカチオン性界面活性剤のもう 1 つの重要なクラスであり、容易に生分解され、毒性が低いか、またはまったくありません。Nα-アシルアルギニンメチルエステルベースの界面活性剤と1,2-ジパルミトイル-sn-プロピルトリオキシル-3-ホスホリルコリンおよび1,2-ジテトラデカノイル-sn-プロピルトリオキシル-3-ホスホリルコリン、モデル膜、および生物との相互作用に関する研究外部バリアの有無により、このクラスの界面活性剤が優れた抗菌性を有することが示されました。結果は、界面活性剤が優れた抗菌活性を有することを示しました。
09 レオロジー特性
界面活性剤のレオロジー特性は、食品、医薬品、油抽出、パーソナルケア、ホームケア製品など、さまざまな業界での用途を決定および予測する上で非常に重要な役割を果たします。アミノ酸系界面活性剤の粘弾性とcmcの関係については、これまで多くの研究が行われてきました。
10 化粧品業界での用途
AAS は、多くのパーソナルケア製品の配合に使用されています。N-ココイルグリシン酸カリウムは肌にやさしく、汚れやメイクを落とす洗顔料に使われています。n-アシル-L-グルタミン酸にはカルボキシル基が 2 つあるため、水溶性が高くなります。これらのAASの中でも、C 12 脂肪酸に基づくAASは、汚れやメイクを落とすために洗顔に広く使用されています.C 18 鎖を持つ AAS は、スキンケア製品の乳化剤として使用されます。N-ラウリル アラニン塩は、肌に刺激を与えないクリーミーな泡を作ることが知られているため、ベビーケア製品の処方に使用できます。練り歯磨きに使用されるN-ラウリルベースのAASは、石鹸に似た優れた洗浄力と強力な酵素阻害効果を備えています.
過去数十年にわたり、化粧品、パーソナルケア製品、および医薬品用の界面活性剤の選択は、低毒性、低刺激性、手触りへのやさしさ、および安全性に重点を置いてきました。これらの製品の消費者は、潜在的な刺激、毒性、および環境要因を強く認識しています。
今日、AAS は、化粧品やパーソナルケア製品の従来の対応物よりも多くの利点があるため、多くのシャンプー、染毛剤、バスソープの配合に使用されています。タンパク質ベースの界面活性剤は、パーソナルケア製品に必要な望ましい特性を備えています。一部の AAS にはフィルム形成機能があり、他の AAS には優れた発泡機能があります。
アミノ酸は、角質層に天然に存在する重要な保湿因子です。表皮細胞が死ぬと、それらは角質層の一部になり、細胞内タンパク質は徐々にアミノ酸に分解されます.これらのアミノ酸はさらに角質層に運ばれ、そこで脂肪または脂肪様物質を表皮角質層に吸収し、皮膚表面の弾力性を改善します。皮膚の天然保湿因子の約50%は、アミノ酸とピロリドンで構成されています。
化粧品の代表的な成分であるコラーゲンにも、肌をやわらかく保つアミノ酸が含まれています。肌荒れやくすみなどの肌トラブルは、アミノ酸不足によるところが大きい。ある研究では、アミノ酸を軟膏に混合すると、皮膚の火傷が緩和され、患部がケロイド瘢痕になることなく正常な状態に戻ることが示されました.
アミノ酸は、損傷したキューティクルのケアにも非常に役立つことがわかっています.乾燥した形のない髪は、ひどく損傷した角質層のアミノ酸濃度が低下している可能性があります.アミノ酸は、キューティクルを毛幹に浸透させ、皮膚から水分を吸収する能力を持っています.アミノ酸ベースの界面活性剤のこの能力は、シャンプー、染毛剤、髪の柔軟剤、ヘアコンディショナーに非常に役立ち、アミノ酸の存在が髪を強くします.
11 日常の化粧品への応用
現在、世界中でアミノ酸ベースの洗剤配合に対する需要が高まっています。AAS は、より優れた洗浄能力、起泡能力、および布地の柔軟化特性を備えていることが知られており、家庭用洗剤、シャンプー、ボディ ウォッシュ、およびその他の用途に適しています。アスパラギン酸由来の両性 AAS は、キレート特性を持つ非常に効果的な洗剤であると報告されています。N-アルキル-β-アミノエトキシ酸からなる洗剤成分を使用すると、皮膚への刺激が軽減されることがわかりました。N-ココイル-β-アミノプロピオネートからなる液体洗剤配合物は、金属表面の油汚れに有効な洗剤であると報告されています。アミノカルボン酸界面活性剤である C 14 CHOHCH 2 NHCH 2 COONa も洗浄力が優れていることが示されており、布地、カーペット、髪、ガラスなどの洗浄に使用されています。アセト酢酸誘導体は、良好な錯化能を有することが知られているため、漂白剤に安定性を与えます。
N-(N'-長鎖アシル-β-アラニル)-β-アラニンに基づく洗剤配合物の調製は、Keigo と Tatsuya によって特許で報告されており、洗浄能力と安定性が向上し、泡が壊れやすく、布地が柔軟になります。 .花王は、N-アシル-1 -N-ヒドロキシ-β-アラニンをベースとした洗剤処方を開発し、低刺激性、高耐水性、高い汚れ除去力を報告しました。
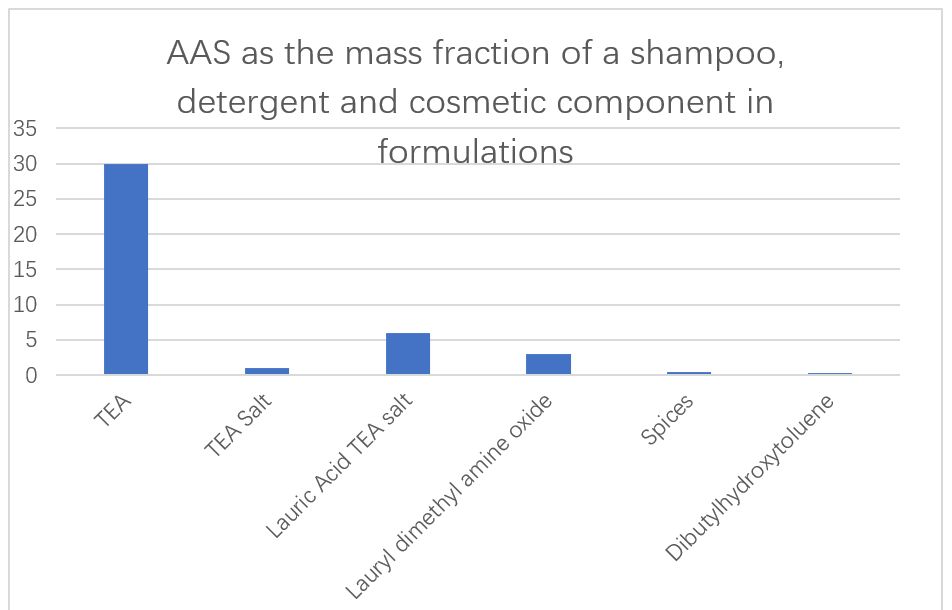
日本企業の味の素は、シャンプー、洗剤、化粧品の主成分として、L-グルタミン酸、L-アルギニン、L-リジンに基づく低毒性で分解しやすい AAS を使用しています (図 13)。洗剤配合物中の酵素添加剤がタンパク質の汚れを除去する能力も報告されています。グルタミン酸、アラニン、メチルグリシン、セリン、アスパラギン酸に由来する N-アシル AAS は、水溶液中で優れた液体洗剤として使用されることが報告されています。これらの界面活性剤は、非常に低い温度でも粘度をまったく増加させず、発泡装置の貯蔵容器から容易に移して均質な泡を得ることができます。
投稿時間: 2022 年 6 月 9 日

